Dras. Carrizo María Mercedes - Darin María Cecilia - Etcheverry Graciela
Introducción
La Enfermedad Trofoblástica Gestacional (ETG) comprende un grupo heterogéneo de tumores originados a partir de la proliferación anormal del tejido trofoblástico.
La incidencia mundial varia, en Europa es de 1,2-1,3 cada 1000 embarazos, en América del Norte entre 0.5 – 1 cada 1000 embarazos; en América del Sur del 1.5 – 6 cada 1000 embarazos y en Asia más de 12 por 1000 embarazos. En algunas áreas de nuestro país (Tucumán, Salta, Jujuy, alrededores de Rosario) hay informes que indican una incidencia de 4 -7 cada 1000 embarazos1.
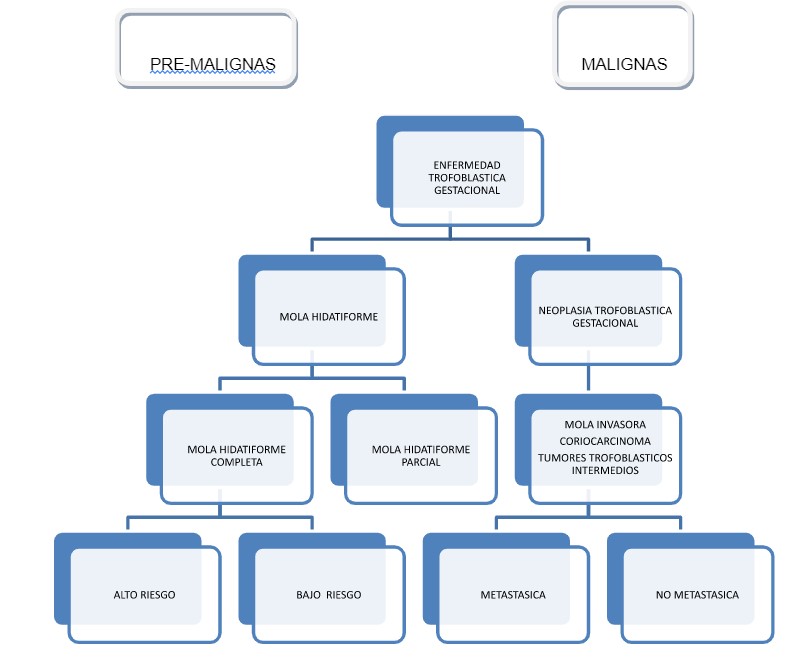
La forma más común de ETG es la mola hidatiforme (MH) también conocida como embarazo molar. Esta anomalía de la gestación que genera una placenta anormal sin feto (Mola Hidatiforme Completa) o con feto incompatible con la vida (Mola Hidatiforme Parcial), comprende el 80% de todas las ETG.
La MH puede involucionar espontáneamente, denominándose mola de regresión espontánea (MRE) o puede persistir trofoblasto activo con comportamiento maligno, definiéndose como Neoplasia Trofoblástica Gestacional (NTG). La NTG puede surgir a partir de un embarazo molar, aborto o gesta de término e incluyen: la mola invasora (MI) representando un 15%, el coriocarcinoma (CC), el tumor trofoblástico del sitio placentario (TTSP) y tumor trofoblástico epitelioide (TTE) comprenden el 5% restante.
El porcentaje de curación es cercano al 100%.Los tratamientos habituales permiten en general preservar la fertilidad.
Mola hidatiforme
La MH ocurre como resultado de una fertilización anormal, puede ser completa (MHC) o parcial (MHP) según diferencias en la morfología, cariotipo y potencial maligno.
El 80% de las MHC son 46XX y se originan por la duplicación de los cromosomas, de un esperma haploide, después de la fertilización de un huevo, en el cual los cromosomas maternos están inactivos o ausentes. El 20% restante tienen cariotipo 46XX o 46XY producto de la fertilización de un óvulo vacío por 2 espermas (dispermia).
Una gran parte de las MHP tienen cariotipo triploide (69XYY o 69XXY), debido más frecuentemente a la fertilización de un ovocito por 2 espermatozoides (polispermia). Otros mecanismos, aunque infrecuentes, son la fertilización de un ovocito por un espermatozoide (por un defecto en la primera división meiótica) o la fertilización de un ovocito diploide (por defecto en la primera división meiótica). Las MHP contienen tejido fetal.
Dentro de los factores de riesgo para esta patología, se han descripto:
- Edad materna: es más frecuente en los embarazos que se producen en las edades extremas de la vida reproductiva (< de 16 años y > de 45 años).
- Embarazo molar previo: incrementa el riesgo 1% - 2%, mientras que luego de dos embarazos molares, el riesgo en el tercer embarazo se incrementa al 15% – 20%.
- Factores dietarios: dietas pobres en carotenos.
Diagnostico y manifestaciones clínicas:
El diagnóstico de sospecha de MH se basa en los:
- Síntomas clínicos
- Hallazgos ecográficos
- Niveles de βhCG (sub βgonadotrofina coriónica humana)
El síntoma más común de la MHC es el sangrado vaginal entre las 6-16 semanas de gestación. Debido al diagnóstico ecográfico temprano durante el embarazo y a los dosajes cuantitativos de βhCG, la mayoría de los casos son detectados antes de que aparezcan signos adicionales tales como: agrandamiento uterino mayor al esperado para el tiempo de gestación, pre-eclampsia (27%), hiperémesis gravídica (25%), hipertiroidismo (7%) y quistes teco-luteínicos (50%). En el 1- 2% de los casos puede desarrollarse una embolización trofoblástica manifestándose con dolor torácico, disnea, taquipnea y taquicardia.
Las MHP tienden a tener un crecimiento más lento y manifestarse más tardíamente, en el 1er o 2do trimestre, frecuentemente con síntomas de aborto incompleto.
El diagnóstico se hace por el examen histológico en el material de curetaje.
Los hallazgos ecográficos en la MHC incluyen útero aumentado de tamaño con imágenes heterogéneas derivadas del edema de las vellosidades coriónicas (snowstorm = tormenta de nieve).
En la MHC la mayoría de las pacientes tienen una marcada elevación de βhCG> 100.000 IU/L. En la MHP elevaciones de los niveles de βhCG se observa en menos del 10% de las pacientes.
El riesgo de que una MHC de progrese a NTG es de alrededor del 15% al 20% si no cursa con factores de riesgo, asciende al 30% si presenta alguno de los siguientes factores predictores:
- Niveles de βhCG mayores de 100.000 IU/L
- Crecimiento uterino exagerado para la edad gestacional.
- Quistes teco-luteínicos > 6 cm.
- Edad mayor a 40 años.
La MHP tiene un comportamiento benigno en la mayoría de los casos y no se han identificado factores predictores para el desarrollo de NTG. El riesgo de transformación maligna es de alrededor del 4%.
Neoplasia Trofoblástica Gestacional Post-Molar
Se diagnostica de acuerdo a los criterios de la FIGO, cuando el monitoreo de βhCG muestra2:
- Luego de la evacuación molar
- 4 valores de βhCG consecutivos en meseta (≤ 10%) durante ≥ 3 semanas.
- 3 valores de βhCG en aumento ≥ 10% durante ≥ 2 semanas.
- Persistencia de βhCG durante 6 meses o más después de la evacuación molar.
- Presencia de enfermedad metastásica
- Diagnóstico histológico de NTG: mola invasora, coriocarcinoma gestacional, tumor del sitio trofoblástico, tumor epiteloide trofoblástico.
La NTG post-molar incluye la mola hidatiforme invasora (MI) y el coriocarcinoma (CC), se desarrollan en el 15-20% de las MHC y en el 1-5% de las MHP. La incidencia reportada de NTG después de un embarazo molar es 18-29%.
La MI se origina por la extensión por vía tisular directa o vascular de una MH, con invasión extensa por tejido trofoblástico en el miometrio, peritoneo, parametrios y vagina. Constituyen el 15% de los embarazos molares y las metástasis a distancia son infrecuentes. Niveles elevados y persistentes de βhCG, después de la evacuación de un embarazo molar y en ausencia de metástasis conducen al diagnóstico de mola invasora3. Frecuentemente se presenta con hemorragia severa y en ocasiones se diagnostica en la pieza de histerectomía.
El coriocarcinoma es el carcinoma del epitelio coriónico, una forma extremadamente maligna de tumor trofoblástico. Los hallazgos en este tumor epitelial puro incluyen hiperplasia trofoblástica anormal y anaplasia, producción de βhCG, ausencia de vellosidades coriónicas, hemorragia y necrosis4. Se comporta como un sarcoma, por sus características de crecimiento y metástasis.
Puede ocurrir con diferentes tipos de eventos gestacionales incluyendo: MH (50%), gestación de término o pre-término (25%), embarazo tubario o aborto (25%). Aproximadamente 2-3% de las MH progresan a coriocarcinoma.
Los tumores trofoblásticos intermedios (TTI) incluyen el Tumor del Sitio Placentario (TTSP) y el Tumor Trofoblástico Epitelial (TTE),son sub-tipos raros con una incidencia de aproximadamente 1/100.000 embarazos. Representan el 1% de todas las NTG5.
La mayoría de los TTSP siguen a gestaciones no molares y se presentan meses o años después del antecedente de embarazo. Con menor frecuencia se desarrollan después de la evacuación de una MH. Se originan del trofoblasto intersticial, en el sitio de implantación placentaria y consisten predominantemente en trofoblasto intermedio mononuclear sin vellosidades coriónicas que infiltran en forma de láminas o cordones entre las fibras miometriales. Es característico el predominio de células citotrofoblásticas, y en la inmunohistoquímica se encuentran muchas células productoras de prolactina y pocas de gonadotrofinas, por lo cual la producción de βhCG es variable o ausente. Se asocian con menos invasión vascular, necrosis y hemorragia que el coriocarcinoma, por lo que suelen ser tumores confinados al útero con metástasis tardías y relativa insensibilidad a la quimioterapia.
El TTE es una variante rara del TTSP que parece desarrollarse de la transformación neoplásica del trofoblasto intermedio, después de años de un parto a término6.
Estadificación:
Las NTG deben ser estadificada de acuerdo a la estadificación FIGO.
|
Estadio |
Definición |
|
I |
Tumor confinado al útero |
|
II |
Tumor extendido a otras estructuras genitales (ovario, trompas, vagina, ligamento ancho) por extensión directa o metástasis |
|
III |
Metástasis pulmonares |
|
IV |
Todos los otros sitios de metástasis a distancia |
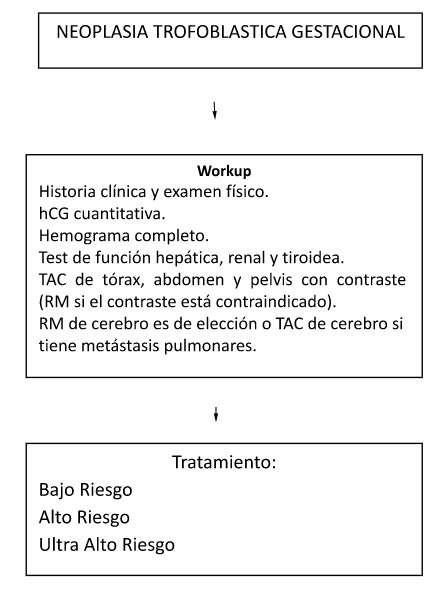
Todas las pacientes con NTG postmolar y aquellas con coriocarcinoma presentan características clínicas, de imágenes y datos de βhCG utilizados para completar el sistema de puntuación pronostica FIGO 2000, que está basado en factores de riesgo individuales y permite definir los tratamientos de los diferentes grupos de riesgo2.
La suma de valores permite categorizar las NTG según el score en: Bajo Riesgo (0-6), Alto Riesgo (7-12) y Ultra Alto Riesgo (≥137,8).
Este score de pronóstico no es aplicable a los TTSP y TTE5.
Sistema de clasificación con score pronóstico (FIGO, OMS, ISSTD e ISGS):
|
0 |
1 |
2 |
4 |
|
|
Edad (años) |
< 40 |
≥ 40 |
||
|
Antecedente de embarazo |
Mola Hidatiforme |
Aborto/desconocido |
Embarazo de término |
|
|
Intervalo desde evento en meses |
< 4 |
4-6 |
7-12 |
>12 |
|
Valor deβhCG (UI/L) al inicio del tratamiento |
< 103 |
103 - < 104 |
104-105 |
≥ 105 |
|
Tamaño tumoral >, incluyendo el útero (cm) |
< 3 |
3– 5 |
>5 |
|
|
Sitio de metástasis |
Pulmón Vagina |
Bazo - Riñón |
Gastrointestinal |
Cerebro– Hígado |
|
N° de metástasis identificadas |
0 |
1-4 |
5-8 |
>8 |
|
Fracaso a quimioterapia previa |
1 droga |
2 ó más drogas |
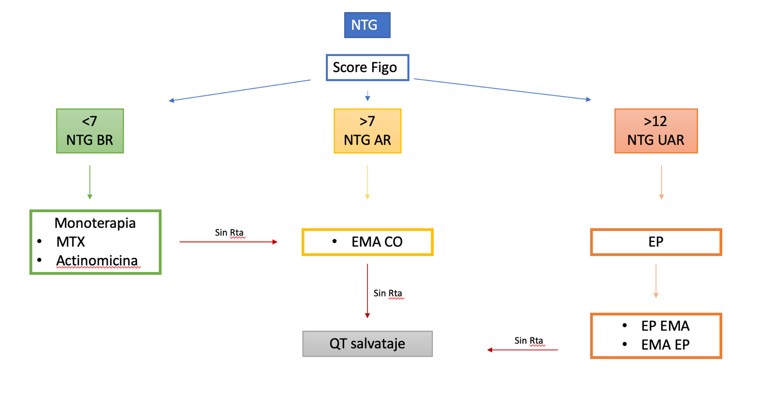
BAJO RIESGO: 0 – 6 PUNTOS
ALTO RIESGO: ≥ 7 PUNTOS
ULTRA ALTO RIESGO: ≥ 13 PUNTOS
Mola Hidatiforme (MH)
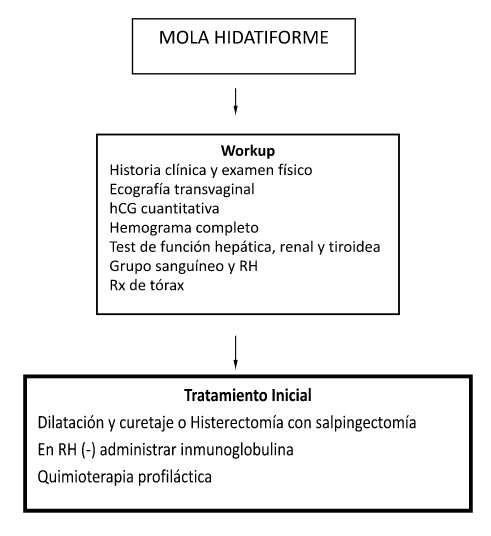
Tratamiento
- Dilatación y evacuación aspirativa con curetaje, idealmente bajo guía ecográfica.
- Rho (D) inmunoglobulina: debe ser administrada en el momento de la evacuación en pacientes con tipos sanguíneos Rh (-).
- Agentes uterotónicos: deben ser administradas durante el procedimiento y continuar por algunas horas durante el post-operatorio, para reducir el riesgo de sangrado abundante.
- Histerectomía: puede ser una alternativa para mujeres mayores o que no desean preservar la fertilidad, sobre todo en mujeres mayores de 40 años por el mayor riesgo de NTG post molar.
- Quimioterapia profiláctica9,10: en el momento de la evacuación uterina. Es controversial, pero puede reducir la incidencia de NTG post-molar en 3-8%. La administración de metotrexate o dactinomicina, puede ser considerado en pacientes que no puedan tener seguimiento adecuado o con alto riesgo de neoplasia trofoblástica gestacional (NTG) post-molar: > 40 años, niveles de βhCG> 100.000 UI/Lt, agrandamiento uterino excesivo y/o quistes teco-luteínicos > de 6 cm.
Las complicaciones pulmonares aparecen en menos del 1% de los casos, pero en el 20% delas pacientes con úteros con tamaño mayor o igual a 14-16 semanas. En estas pacientes se sugiere la realización de gases en sangre y controlar la saturación de oxígeno. El distres respiratorio puede darse por embolización trofoblástica o sobrecarga cardíaca debido a anemia, hipertiroidismo, preeclampsia o sobrecarga hídrica iatrogénica.
Las complicaciones médicas suelen resolverse luego de la aspiración y curetaje. Los quistes teca luteínicos se asocian con la hiperestimulación sobre los ovarios de la βhCG. Los mismos suelen resolverse luego del descenso de la βhCG9
El estudio histopatológico y si es posible el testeo genético confirman el diagnóstico.
Seguimiento
El monitoreo de βhCG es esencial luego de la evacuación de una MH, hasta obtener valores normales.
Las moléculas de βhCG asociadas con la ETG son más heterogéneas y degradadas que las asociadas con un embarazo normal3,11
El monitoreo debe ser realizado con un método capaz de detectar todas las formas de hCG, incluyendo beta-hCG, core hCG, nicked-free beta, beta core y formas hiperglicosiladas6,10,12.
La guía FIGO recomienda dosaje cada 2 semanas hasta su negativización, y confirmaron otro valor negativo10
En el caso de molas parciales no es necesario realizar seguimiento luego de un valor negativo. En las molas completas seguimiento es mensual durante 6 meses.
Según la guía NCCN el dosaje de βhCG se realiza cada una o dos semanas, hasta obtener 3 valores consecutivos normales, luego la βhCG debe ser medida dos veces más, cada 3 meses de intervalo13
Se sugiere esperar para un nuevo embarazo al menos 12 meses, y agregar tratamiento anticonceptivo.
En el caso que ocurra embarazo durante el seguimiento, una vez que se normalizaron los valores de βhCG, no se indica la finalización del mismo.
Las pacientes con antecedente de mola, tienen 1-2% de riesgo de repetir la patología en un embarazo subsiguiente. El riesgo es aún mayor en pacientes con 2 ó más molas previas. En estos casos se sugiere la realización de testeo germinal para mutaciones en NLRP7 y KHDC3L, las cuales se presentan en más de la mitad de los casos. Se sugiere que estas pacientes realicen tratamientos de fertilidad de alta complejidad, recomendándose donación de ovocitos si presentan la mutación14,15.
Mola Hidatiforme coexistente con embarazo normal
Esta situación se presenta en 1/22000-100000 embarazos. Si bien la tasa de abortos es alta, un 40-60% llegan al término. Pueden presentar complicaciones como partos prematuros, hipertensión o hemorragia.9
Ante la ausencia de complicaciones o hallazgos patológicos en laecografía, se puede continuar con el embarazo.
Neoplasia Trofoblástica Gestacional
• Neoplasia Trofoblástica Gestacional de bajo riesgo (NTG-BR)
Tratamiento
La línea de tratamiento estándar es quimioterapia con un solo agente: Metotrexate o Actinomicina10
Los índices de remisión primaria para el régimen de metotrexate (MTX) multidía son de 87-93% para el protocolo de 5 días y de 74-93% para el de 8 días, con rescate de leucovorina. Para el tratamiento inicial con 5 días de Actinomicina D son de 77-94% y para el bolo de 69-90%8.
Opciones de tratamiento NTG BR10
- MTX-FA régimen de 8 días (50 mg MTX IMdia 1,3,5,7 con leucovorina 15 mg V0 24hsdespués de MTX los días 2,4,6,8); repetir cada 2 semanas.
- MTX 0.4 mg/kg (max. 25 mg) IV o IM por 5 días cada 2 semanas.
- Actinomycin D pulso 1.25 mg/m2 IV cada 2 semanas
- ActinomycinD0.5mgIV cada 2 semanas
- Otros: MTX 30–50 mg/ IM semanal
- MTX 300 mg/m2 cada 2 semanas.
El monitoreo de respuesta a la quimioterapia se hace con dosajes de βhCG cada una o dos semanas. Cuando la βhCG se ha normalizado se recomiendan 2 o 3 ciclos de tratamiento adicionales para minimizar el riesgo de recurrencia. La quimioterapia debe continuarse hasta que se negativice la βhCG y luego se debe administrar 1 ciclo de consolidación. Durante todo el tratamiento se debe monitorizar la respuesta con determinaciones de βhCG semanal.
Se considera resistencia a la quimioterapia cuando la βhCG hace un plateau en 3 ciclos consecutivos o se eleva en 2 ciclos consecutivos. En estos casos está indicada una segunda línea de quimioterapia., en general con esquema de múltiples drogas como en NTG de alto riesgo16.
Se considera remisión cuando obtenemos 3 dosajes negativos sucesivos luego de la consolidación.
Seguimiento
Dosaje mensual de βhCG acompañado de anticoncepción de preferencia oral por un año.
• Neoplasia Trofoblástica Gestacional de alto riesgo (NTG AR)
Tratamiento
El tratamiento consiste en esquemas de múltiples drogas, logrando tasas de sobrevida mayores o iguales al 95%10
- EMA/CO
(Etopósido, Metotrexate, Actinomicina / Ciclofosfamida, Vincristina). Repetido cada 2 semanas hasta que la normalización de βhCG.
Día 1
- Etopósido: 100mg/m2 IV en infusión de 30 min.
- Actinomicina D 0.5 mg IV bolo
- Metotrexate: 100mg/m2 EV en bolo. 300mg/m2 IV infusión de 12 hs
Días 2
- Etopósido: 100mg/m2 IV en infusión de 30 min.
- Actinomicina D 0.5 mg IV bolo
- Leucovorina 15 mg VO ó IM cada 12 horas por 4 dosis comenzando 24 horas después del inicio de la infusión de metotrexate.
Día 8
- Ciclofosfamida: 600 mg/m2 IV en infusión de 30 minutos
- Vincristina 1mg/m2 (max 2 mg) IV en 5 a 10 minutos
Dado que el tratamiento es con intención curativa, es importante evitar demoras entre los ciclos. Si es necesario se debe recurrir a factores estimulantes de colonias luego del primer episodio de neutropenia. Debe continuar hasta obtener dosajes negativos deβhCG. Se deben administrar 3 ciclos de consolidación. En la enfermedad metastásica, las imágenes pueden permanecer durante muchos meses, solo se debe tratar si aumenta el valor de βhCG.
• Neoplasia Trofoblástica Gestacional Ultra Alto Riesgo (NTG UAR)
Tratamiento
Este grupo incluye a pacientes con score mayor a 13, pacientes con metástasis hepáticas, cerebrales, o múltiples, que tienen pobre respuesta a la primera línea de quimioterapia.
En casos con enfermedad masiva, la utilización de quimioterapia con esquemas estándar puede provocar sangrado severo, acidosis metabólica, mielosupresión, sepsis y falla multiorgánica. Para evitar esto, se sugiere comenzar con el tratamiento con esquemas más graduales13.
- Etopósido 100mg/m2/día IV y Cisplatino 20mg/m2/día IV (días 1 y 2) cada 7 días por 1 a 3 cursos, antes de comenzar EMA/EP
- EMA/EP: repetido cada 2 semanas
Día 1
- Etopósido: 100mg/m2/día IV
- Actinomicina 0.5 mg IV en bolo
- Metotrexate: 100 mg/m2 IV en bolo seguido de 200mg/m2 infusión IV de 12 hs
- Leucovorina 15 mg VO o IM cada 12 horas por 4 dosis comenzando 24 horas después del comienzo de la infusión de metotrexate
Días 2
- Etopósido: 100mg/m2/día IV
- Actinomicina 0.5 mg IV en bolo
Día 8
- Etopósido: 100mg/m2 IV
- Cisplatino: 75 mg/m2 IV
- Filgastrin 300 mcg SC días 9-14 en cada ciclo de tratamiento
- EP/EMA: repetido cada 2 semanas
Día 1:
- Etopósido: 150mg/m2 IV
- Cisplatino: 75 mg/m2 IV
Día 8:
- Etopósido: 100mg/m2 IV
- Metotrexate: 300mg/m2 IV infusión de 12 hs
- Leucovotina 15 mg VO o IM cada 12 horas por 4 dosis comenzando 24 horas después del inicio de la infusión de metotrexate
- Actinomicina 0.5 mg IV en bolo
- Filgastrin 300 mcg SC días 3-6 y 10-13 de cada ciclo de tratamiento
Considerar consolidación con 4 ciclos más.
Manejo de las metástasis
Metástasis cerebrales
El manejo de las metástasis cerebrales es controversial. Se ha utilizado radioterapia concurrente con quimioterapia con el fin de limitar las complicaciones hemorrágicas. La combinación de radioterapia y quimioterapia logra tasas de curación de hasta 75%. Similares resultados se han encontrado en pacientes a quienes al esquema de EMA-CO/ EP/EMA se le incorpora infusión de metrotexate 1g/m2 EV combinado con MTX intratecal 9, 17,18.
No está establecido el tratamiento para las metástasis hepáticas u otros sitios, si bien seutilizan esquemas multimodales, se puede plantear resección quirúrgica en pacientes con metástasis aisladas, embolización de metástasis hepáticas, o radioterapia9.
Seguimiento en la NTG AR y UAR
Seguimiento semanal de βhCG durante los primeros 3 meses. Luego, una vez por mes hasta el año. Más allá del año continuar con controles semestrales. Se sugiere control de al menos 5 años. Las recaídas más allá de los 7 años son excepcionales,9,19.
Indicar tratamiento anticonceptivo durante el tratamiento, y al menos el primer año de seguimiento.
Quimioterapia de salvataje.
En pacientes con recaída o persistencia se indican tratamiento con regímenes que incluyan etopósido y platino, con frecuencia combinados con resección quirúrgica del tumor persistente pueden resultar en curas cercanas al 80-90% en pacientes con enfermedad de alto riesgo20.
TP/TE (paclitaxel, cisplatino/paclitaxel, etopósido)
EMA/EP o EP/EMA son regímenes considerados apropiados para pacientes que han respondido a EMA/CO pero tienen bajos niveles de βhCG en plateau o una re-elevación de βhCG después de una respuesta completa a EMA/CO.
Los índices de respuesta completa/remisión con EMA/EP para enfermedad resistente a EMA/CO son entre 75-85%21.
Recientemente se ha identificado al ligando PD1 en las lesiones trofoblásticas, y se han descripto pacientes con resistencia a drogas estándar que utilizaron inmunoterapia, como pembrolizumab y avelumab, con buena respuesta. Estas drogas presentan mejor perfil de toxicidad logrando altas tasas de curacion22,23.
Se encuentra un curso un estudio fase II que combina avelumab con metotrexate como primera línea de tratamiento en NTG BR. Se estima una primer publicación de resultados en el 202324
Opciones terapia de salvataje10
- EP-EMA
- TP/TE (paclitaxel, cisplatino/paclitaxel, etopósido)
- MBE (metotrexate, bleomicina, etopósido)
- VIP o ICE (etopósido, ifosfamida, y cisplatino/ carboplatino)
- BEP (bleomicina, etopósido, cisplatino)
- FA(5-fluorouracilo, actinomicina-D)
- FAEV(floxuridina, actinomicina-D, etopósido, vincristina)
- Quimioterapia en altas dosis con factores estimulantes de colonias.
- Inmunoterapiacon pembrolizumab
Tumor Sitio de Trofoblastico y Tumor Trofoblastico epiteloide
Tratamiento
Son enfermedades relativamente quimioresistentes. El tratamiento se determina según la presencia o ausencia de enfermedad metastásica y el tiempo entre el último embarazo y el diagnóstico
- Estadio I
- embarazo previo<48 meses: Histerectomía
- embarazo previo ≥ 48 meses: histerectomía y adyuvancia con platino. Se puede considerar inmunoterapia
- Estadio II y III
- embarazo previo<48 meses: Histerectomía y adyuvancia con EP/EMA.
- embarazo previo ≥ 48 meses: Histerectomía y adyuvancia con EP/EMA. Se puede considerar inmunoterapia
- Estadio IV:
- Histerectomía y adyuvancia con EP/EMA. Se puede considerar inmunoterapia
Seguimiento
Se aconseja al menos βhCG semanal hasta 6 semanas después de la normalización, seguido de control mensual por 12 meses. Continuar seguimiento junto con imágenes durante 10 años19.
Bibliografía
- Consenso FASGO “Enfermedad Trofoblástica Gestacional” http://www.fasgo.org.ar/archivos/consensos/CONSENSO_FASGO_ETG.pdf
- Committee FO. FIGO staging for gestational trophoblastic neoplasia 2000. FIGO Oncology Committee. Int J GynaecolObstet2002;77:285-287
- Lurain JR. Gestational trophoblastic disease I: epidemiology, pathology, clinical presentation and diagnosis of gestational trophoblastic disease, and management of hydatiform mole. Am J ObstetGynecol2010;203:539
- SecklMJ,Sebire NJ, Berkowitz RS. Gestational trophoblastic disease. Lancet 2010;376:717-729
- Horowitz NS, Goldstein DP, Berkowitz RS. Placental site trophoblastic tumors and epithelioid trophoblastic tumors: Biology, natural history, and treatment modalities. GynecolOncol2017;144:208-214
- Brown J, Naumann RW, Seckl MJ, Schink J. 15 years of progress in gestational trophoblastic disease: Scoring, standardization, and salvage. GynecolOncol2017;144:200-207
- Ngan HY, Bender H, Benedet JL, et al. Gestational trophoblastic neoplasia, FIGO 2000 staging and classification. Int J GynaecolObstet 2003;83 Suppl 1:175-177
- Goldstein DP, Berkowitz RS, Horowitz NS. Optimal management of low-risk gestational trophoblastic neoplasia. Expert Rev Anticancer Ther2015;15:1293-1304
- Sopper J. Gestational Trophoblastic Disease. Current evaluation and management. ObstetGynecol2021;137:355–70
- Ngan H, Seckl M, Berkowitz R, et al. Update on the diagnosis and management of gestational trophoblastic disease FIGO CANCER REPORT 2018 Int J GynecolObstet 2018; 143 (Suppl. 2): 79–85
- Cole LA. Human chorionic gonadotropin and associated molecules. Expert Rev Mol Diagn 2009;9:51-73
- Muller CY, Cole LA. The quagmire of hCG testing in gynecologic oncology. Gynecol Oncol 2009;112:663-672
- Gestational Trophoblastic Neoplasia. NCCN guidelines. Version 2.2020
- Fisher RA, Khatoon R, Paradinas FJ, Roberts AP, Newlands ES. Repetitive complete hydatidiform mole can be biparental in origin and either male or female. Hum Reprod 2000;15:594– 8. doi: 10.1093/humanrep/15.3.594
- Andreasen L, Christiansen OB, Niemann I, Bolund L, Sunde L. NLRP7 or KhDC3L genes and the etiology of molar pregnan- cies and recurrent miscarriage. Mol Hum Reprod 2013;19:773– 81. doi: 10.1093/molehr/gat056
- Mangili G, Lorusso D, Brown J, et al. Trophoblastic disease review for diagnosis and management: a joint report from the International Society for the Study of Trophoblastic Disease, European Organisation for the Treatment of Trophoblastic Disease, and Gynecologic Cancer InterGroup. Int J Gynecol Cancer 2014;24:S 109-116
- Evans AC, Soper JT, Clarke-Pearson DL, Berchuck A, Rodri- guez GC, Hammond CB, et al. Gestational trophoblastic dis- ease metastatic to the central nervous system. Gynecol Oncol 1995;59:226–30. doi: 10.1006/gyno.1995.0013
- Savage P, Kelpanides I, Tuthill M, Seckl M. Brain metastases in gestational trophoblast neoplasia: an update on incidence, man- agement and outcome. Gynecol Oncol 2015;137:73–6. doi: 10. 1016/j.ygyno.2015.01.530
- Lok C, van Trommel N, Massuger L, et al. Practical clinical guidelines of the EOTTD for treatment and referral of gestational trophoblastic disease. European Journal of Cancer 130 (2020) 228e240
- Lurain JR, Schink JC. Importance of salvage therapy in the management of high-risk gestational trophoblastic neoplasia. J Reprod Med 2012;57:219-224
- Newlands ES, Mulholland PJ, Holden L, et al. Etoposide and cisplatin/etoposide, methotrexate, and actinomycin D (EMA) chemotherapy for patients with high-risk gestational trophoblastic tumors refractory to EMA/cyclophosphamide and vincristine chemotherapy and patients presenting with metastatic placental site trophoblastic tumors. J Clin Oncol 2000;18:854-859
- Ghorani E, Kaur B, Fisher RA, Short D, Joneborg U, Carlson JW, et al. Pembrolizumab is effective for drug-resistant gesta- tional trophoblastic neoplasia. Lancet 2017;390:2343–45. doi: 10.1016/S0140-6736(17)32894-5
- You B, Bolze PA, Lotz JP, Massardier J, Gladief K. Avelumab in patients with gestational trophoblastic tumors with resistance to single-agent chemotherapy: cohort A of the TROPHIM- MUN phase II trial. J Clin Oncol 2020;38:3129–37. doi: 10. 1200/JCO.20.00803
- TROPHAMET, NCT04396223